在生物技術與醫藥研發的前沿領域,脂質體,特別是陽離子脂質體技術,正扮演著日益重要的角色。它是一種高效、安全的載體系統,廣泛應用于藥物遞送、基因治療以及疫苗研發等多個層面。
什么是脂質體?
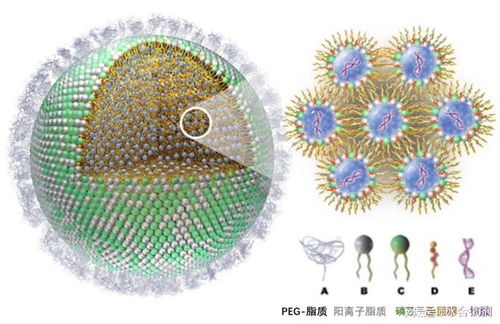
脂質體是一種由磷脂和膽固醇等脂質分子在水相中自發形成的、具有雙層膜結構的微小球形囊泡。其結構模擬了天然細胞膜,內部可以包裹親水性物質(如核酸、蛋白質),而疏水性物質則可以嵌入脂質雙層中。這種獨特的結構使其成為理想的藥物或功能性分子載體,能夠保護內容物不被降解,并促進其被細胞攝取。
核心組成:磷脂與膽固醇
脂質體的構建基礎主要依賴于兩種關鍵成分:
- 磷脂:作為脂質雙層的主要骨架,通常是具有親水性“頭部”和疏水性“尾部”的兩親性分子。常見的磷脂包括磷脂酰膽堿(PC)、磷脂酰乙醇胺(PE)等。它們決定了脂質體的穩定性、柔韌性和與生物膜的相容性。
- 膽固醇:在脂質體中扮演著“穩定劑”的角色。它嵌入磷脂雙層中,可以調節膜的流動性、增加其機械強度、減少內容物泄漏,并提高脂質體在血液循環中的穩定性。
陽離子脂質體的技術核心
陽離子脂質體是脂質體技術的一個重要分支。其關鍵創新在于在經典磷脂/膽固醇組成的基礎上,引入了帶有正電荷的脂質成分,例如DOTAP、DC-Chol等。這些陽離子脂質賦予了整個脂質體顆粒表面凈正電荷。
正電荷的作用至關重要:
- 高效結合:細胞膜表面和DNA/RNA等遺傳物質(基因、siRNA、mRNA)通常帶負電荷。陽離子脂質體的正電荷可以通過靜電作用,強力且高效地吸附并壓縮帶負電的核酸分子,形成穩定的“脂質復合物”。
- 促進內吞:帶正電的顆粒更容易與帶負電的細胞膜發生相互作用,從而顯著增強細胞通過內吞作用攝取脂質體及其內容物的效率。
從研發到應用:細胞技術的橋梁
陽離子脂質體技術已成為連接實驗室研究與臨床應用,尤其是細胞層面干預的關鍵橋梁。其主要應用方向包括:
- 基因轉染與基因治療:這是其最經典和成功的應用。陽離子脂質體能夠將治療性基因(如用于糾正遺傳缺陷的DNA)或基因編輯工具(如CRISPR-Cas9組件)安全、高效地導入靶細胞內部,為癌癥、遺傳性疾病等的治療提供了強大工具。實驗室中,它已是細胞轉染的“金標準”試劑之一。
- RNA遞送與疫苗開發:在mRNA疫苗(如新冠疫苗)的革命性進展中,陽離子脂質體或類似的脂質納米顆粒(LNP)技術居功至偉。它們保護脆弱的mRNA分子不被降解,并將其高效遞送至細胞質,指導細胞生產抗原蛋白,從而激發免疫反應。
- 靶向藥物遞送:通過對陽離子脂質體表面進行PEG化(增加循環時間)或連接靶向配體(如抗體、多肽),可以實現對特定細胞或組織(如腫瘤細胞)的主動靶向,提高藥效并降低全身副作用。
- 細胞重編程與再生醫學:在基礎研究中,陽離子脂質體被用于向干細胞或體細胞內遞送重編程因子(如mRNA或蛋白質),誘導其轉變細胞命運,這在組織工程和再生醫學領域具有巨大潛力。
挑戰與未來展望
盡管前景廣闊,陽離子脂質體技術仍面臨一些挑戰,例如體內應用的穩定性、可能的免疫原性、對特定器官的靶向效率等。未來的研發將聚焦于設計更智能、更安全的新型陽離子脂質材料,開發更精準的靶向策略,以及優化大規模生產工藝。
總而言之,陽離子脂質體技術,以其由磷脂和膽固醇構筑的仿生載體為基礎,憑借正電荷的“魔力”,成功打通了從體外到體內、從基因到細胞的遞送通道。它不僅是實驗室中操控細胞的利器,更是推動下一代生物醫藥,尤其是核酸藥物和疫苗發展的核心引擎之一,持續為人類健康帶來革新性的解決方案。